Enzyme sind für das reibungslose Funktionieren aller lebenden Organismen auf der Erde unerlässlich. Sie sind an den meisten, wenn nicht allen chemischen Umwandlungen in der Natur beteiligt, dh an Millionen von Reaktionen sowohl in der Pflanzenwelt als auch in der Tierwelt. Es lohnt sich herauszufinden, was Enzyme sind, wie sie funktionieren und welche Bedeutung sie für die moderne Medizin haben.
Inhaltsverzeichnis
- Enzyme: Struktur
- Regulation der Enzymaktivität
- Enzyme: Rolle
- Enzyme: Nomenklatur
- Enzyme und Medizin
- Krankheiten, die aus dysfunktionellen Enzymen resultieren
- Enzyme: diagnostische Verwendung
- Enzyme und Behandlung
Enzyme sind Proteinmoleküle, die verschiedene chemische Reaktionen in lebenden Organismen, einschließlich des menschlichen Körpers, beschleunigen oder sogar ermöglichen.
Aus chemischer Sicht sind dies Katalysatoren, d. H. Partikel, die die Reaktion intensivieren, sich jedoch während der Reaktion nicht abnutzen. Diese Steigerung der Effizienz chemischer Umwandlungen ist oft enorm, natürliche Katalysatoren können die Reaktionszeit von mehreren Jahren auf einige Sekunden verkürzen.
Enzyme kommen in allen Bereichen des Körpers vor: in Zellen, im extrazellulären Raum, in Geweben, in Organen und in ihrem Licht, welche Katalysatoren ein bestimmtes Gewebe produziert, bestimmt seine spezifischen Eigenschaften und die Rolle, die es im Körper spielt.
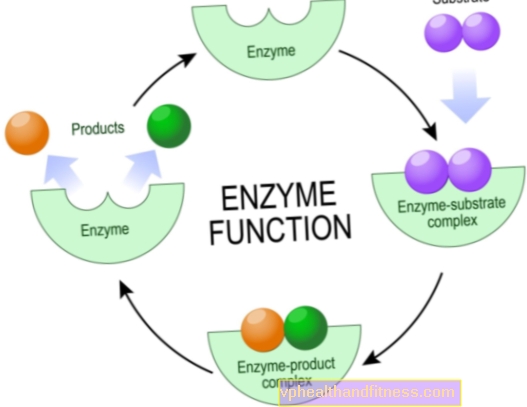
Die meisten Enzyme sind sehr spezifisch, was bedeutet, dass jedes von ihnen nur für eine Art chemischer Reaktion verantwortlich ist, an der bestimmte Partikel - die Substrate - beteiligt sind und nur sie mit einem bestimmten Enzym interagieren können.
Die Aktivität natürlicher Katalysatoren hängt von vielen Faktoren ab: der Reaktionsumgebung, z. B. Temperatur, pH-Wert, Anwesenheit bestimmter Ionen, Aktivatoren - sie verstärken die Wirkung von Enzymen und Inhibitoren, die dieser Aktivität entgegenwirken.
Enzyme: Struktur
Wie bereits erwähnt, sind die meisten Enzyme Proteine, sie haben eine sehr unterschiedliche Struktur: von mehreren Dutzend Aminosäuren bis zu mehreren Tausend, die in einer unterschiedlichen räumlichen Struktur angeordnet sind.
Es ist die Form ihrer Bildung (die sogenannte quaternäre Struktur) und die Tatsache, dass die meisten Enzyme viel größer sind als die Reaktanten ihrer Reaktionen, ist weitgehend für ihre Aktivität verantwortlich.
Dies ist auf die Tatsache zurückzuführen, dass nur eine bestimmte Region in der Struktur von Enzymen das sogenannte aktive Zentrum ist, d. H. Das Fragment, das für die Durchführung der Reaktion verantwortlich ist.
Die Aufgabe der verbleibenden Fragmente des Moleküls besteht darin, ein spezifisches Substrat zu binden, seltener andere Verbindungen, die die Aktivität des Enzyms beeinflussen.
Es ist zu wissen, dass die Struktur des Katalysators so ausgelegt ist, dass das Verbindungssubstrat in Bezug auf einen "Schlüssel zum Schloss" ideal angepasst ist.
Wie alle Proteine werden Enzyme in den Ribosomen aus dem im Kern dicht gepackten genetischen Material - der DNA - hergestellt, wodurch eine sogenannte Primärstruktur entsteht.
Dann wird es mehrmals gefaltet - seine Form ändert sich, manchmal werden Zucker, Metallionen oder Fettreste hinzugefügt.
Das Ergebnis all dieser Prozesse ist die Bildung einer aktiven quaternären Struktur, d. H. Einer vollständig biologisch aktiven Form.
In vielen Fällen führen mehrere Enzympartikel zusammen eine Reihe chemischer Reaktionen durch und beschleunigen so den Prozess.
Es kommt vor, dass es in mehreren Geweben Enzyme gibt, die dieselbe Reaktion katalysieren, aber strukturell sind sie einander nicht immer ähnlich, wir nennen sie Isoenzyme.
Die Namen der Isoenzyme sind trotz des Unterschieds in Ort und Struktur gleich, aber diese Unterschiede haben praktische Anwendung. Dank dessen ist es möglich, in Labortests nur die Enzymfraktionen zu bestimmen, die von einem bestimmten Organ stammen.
Die Wirkmechanismen von Enzymen sind vielfältig, aber aus chemischer Sicht besteht ihre Aufgabe immer darin, die Aktivierungsenergie der Reaktion zu reduzieren. Dies ist die Energiemenge, die die Substrate haben müssen, damit der Prozess stattfinden kann.
Dieser Effekt kann erreicht werden, indem eine geeignete Umgebung für die Durchführung der Reaktion geschaffen wird, ein anderer chemischer Weg verwendet wird, um die gleichen Produkte zu erhalten, oder eine geeignete räumliche Anordnung der Substrate.
Jeder dieser Mechanismen kann von Enzymen genutzt werden.
Regulation der Enzymaktivität
Die Wirkung von Enzymen hängt von Umweltparametern ab: Temperatur, pH-Wert und anderen. Jeder der natürlichen Katalysatoren hat unter bestimmten Bedingungen seine eigene optimale Leistung, die je nach Toleranz gegenüber Umgebungsbedingungen sehr unterschiedlich sein kann.
Im Falle der Temperatur laufen die meisten enzymatischen Reaktionen bei höheren Temperaturen schneller ab, aber bei einer bestimmten Temperatur sinkt die Effizienz der Reaktion schnell, was durch thermische Schädigung des Enzyms (Denaturierung) verursacht wird.
Hormone lassen sich strukturell in zwei Gruppen einteilen:
- einfach - das sind nur Proteinpartikel
- Komplex - der die Bindung einer Nicht-Protein-Gruppe erfordert - ein Cofaktor an ihre Aktivität
Letztere spielen eine Schlüsselrolle bei der richtigen Aktivität und Regulation von Enzymen.
Cofaktoren können wiederum in zwei Gruppen unterteilt werden: diejenigen, die für die Funktion des Enzyms erforderlich sind und stark damit verbunden sind - dies sind die sogenannten prothetischen Gruppen, es können Metalle, organische Moleküle wie beispielsweise Häm sein.
Die zweite Gruppe sind Coenzyme, sie sind normalerweise für den Transfer von Substraten oder Elektronen verantwortlich und ihre Bindung an das Enzym ist schwach. Diese Gruppe umfasst beispielsweise Folsäure, Coenzym A. Es ist bekannt, dass viele Vitamine die Rolle von Cofaktoren spielen.
Inhibitoren erfüllen eine völlig andere Aufgabe, sie sind Partikel, die die enzymatische Aktivität durch Bindung an das Enzym hemmen.
Es gibt verschiedene Arten von Inhibitoren:
- irreversibel - sie bewirken eine dauerhafte Inaktivierung des Moleküls und die Reaktion kann erst nach der Produktion eines neuen Enzyms stattfinden
- wettbewerbsfähig - in diesem Fall hat der Inhibitor eine Struktur ähnlich dem Substrat, so dass sie um das aktive Zentrum konkurrieren. Wenn ein Inhibitor gebunden ist, schlägt die Reaktion fehl, solange das Substrat normal ist
- nicht kompetitiv - solche Inhibitoren binden das Enzym an einer anderen Stelle als dem Substrat, so dass es sich an das Enzym anlagern kann, aber die Reaktion findet nicht statt
Bei einer viel höheren Konzentration des Substrats als der Inhibitor wird die Wirkung des kompetitiven Inhibitors überwunden, da er aus der "Konkurrenz" um das aktive Zentrum herauswächst. Im Falle einer nicht kompetitiven Konzentration kann seine Wirkung nicht durch Erhöhen der Konzentration des Substrats überwunden werden.
Zusätzlich zur Regulierung der Aktivator- und Inhibitorsysteme gibt es viele andere Methoden zur Steuerung der Enzymaktivität.
Sie betreffen die Kontrolle der Produktion der Zelle auf der Ebene der Proteinbildung sowie die Regulation der sogenannten posttranslationalen Verarbeitung, d. H. Änderungen der Struktur eines Proteinmoleküls, die unmittelbar nach seiner Synthese im Ribosom auftreten. Diese Modifikationen verkürzen beispielsweise die Polypeptidkette.
Andere Regulationsmethoden betreffen die Trennung und Platzierung von Enzymen in geeigneten Bereichen: zellulär und in bestimmten Organellen oder im extrazellulären Kompartiment.
Es gibt einen weiteren wichtigen Regulierungsmechanismus - negatives Feedback - es ist das primäre Kontrollsystem im endokrinen System. Es funktioniert nach dem Prinzip der Hemmung.
Dies bedeutet, dass ein Enzym, wenn es zu viel eines bestimmten Hormons produziert, an dieses bindet, seine Aktivität hemmt und die Synthese verringert, sodass das Reaktionsprodukt selbst seine Produktion hemmt.
Enzyme: Rolle
Jedes Gewebe des menschlichen Körpers produziert einen bestimmten Satz von Enzymen, der die Rolle dieser Zellen für die Funktion des Körpers definiert. Was diese Enzyme sind, wird durch den genetischen Code definiert und welche Regionen in einer bestimmten Zelle aktiv sind.
Tausende von chemischen Reaktionen finden zu jeder Zeit im menschlichen Körper statt, für die jeweils ein bestimmtes Enzym erforderlich ist. Daher wäre es schwierig, alle in unserem Körper vorhandenen Partikel aufzulisten.
Es lohnt sich jedoch, einige der charakteristischsten zu kennen:
- Verdauungsenzyme - werden von den Geweben des Verdauungssystems produziert und zerlegen Lebensmittel in einfache Verbindungen, da nur diese vom Blut aufgenommen werden können. Sie sind extrazelluläre Enzyme und erfüllen daher ihre Hauptaufgabe außerhalb der Zellen, in denen sie produziert werden. Einige dieser Enzyme werden in inaktiver Form gebildet, sogenannte Proenzyme oder Zymogene, und im Magen-Darm-Trakt aktiviert. Die Verdauungsenzyme umfassen beispielsweise Amylase, Lipase, Trypsin.
- Myosin ist ein Enzym, das in den Muskeln vorkommt. Es baut ATP-Moleküle ab, die Energieträger sind, wodurch sich die Muskelfasern zusammenziehen.
- Peroxidasen sind oxidierende Enzyme und Katalasen, d. H. Reduzierende Enzyme
- Acetylcholinesterase ist ein Enzym, das Acetylcholin, einen der Botenstoffe im Nervensystem, abbaut
- Monoaminoxidase ist das in der Leber am häufigsten vorkommende Enzym und für den Abbau von Adrenalin, Noradrenalin und einigen Medikamenten verantwortlich
- Cytochomoxidase, ein sehr wichtiges intrazelluläres Enzym, das für Energieänderungen verantwortlich ist
- Lysozym, eine Substanz, die beispielsweise in Tränen oder Speichel vorhanden ist und Schutzfunktionen erfüllt, zerstört Krankheitserreger
- Alkoholdehydrogenase, ein Enzym in der Leber, das für den Abbau von Ethanol verantwortlich ist
- Alkalische Phosphatase ist am Knochenaufbau durch Osteoblasten beteiligt
Enzyme: Nomenklatur
Enzymnamen sind oft recht kompliziert, da sie sich aus dem Namen der von ihnen durchgeführten Reaktion und dem an der Reaktion beteiligten Substrat, z. B. 5-Hydroxytryptophan-Decarboxylase, ableiten.
Typischerweise wird das Suffix "-aza" zum allgemeinen Namen der Reaktion hinzugefügt, und der zweite Teil des Enzymnamens wird durch den Namen der Verbindung gebildet, die diese Reaktion durchläuft.
Es kommt vor, dass der Name einfach ist und dann von einem Substrat stammt, z. B. Lactase (Enzym, das Lactose abbaut).
Seltener leiten sich die Namen von Enzymen von einem allgemeinen Prozess ab, der unter ihrer Beteiligung stattfindet, z. B. DNA-Gyrase, d. H. Dem Enzym, das für rotierende DNA-Stränge verantwortlich ist.
Einige Enzyme haben schließlich gebräuchliche Namen oder Namen, die von ihrem Entdecker vergeben wurden, wie Pepsin (das Proteine im Verdauungstrakt abbaut) oder Lysozym (ein in Tränen enthaltenes bakterizides Enzym).
Es gibt auch eine kleine Gruppe von Restriktionsenzymen, die für das Schneiden von DNA-Strängen verantwortlich sind. In diesem Fall stammt der Name von dem Mikroorganismus, aus dem das Enzym isoliert wurde.
Die Internationale Union für Biochemie und Molekularbiologie hat die Regeln für die Benennung von Enzymen eingeführt und in mehrere Klassen unterteilt, um die Nomenklatur zu standardisieren.
Es hat die zuvor beschriebenen Namen nicht ersetzt, sondern ist eine Ergänzung, die hauptsächlich von Wissenschaftlern verwendet wird.
Gemäß den Regeln der Europäischen Union wird jedes Enzym durch eine Folge von Zeichen beschrieben: EC x.xx.xx.xx - wobei die erste Ziffer die Klasse, nachfolgende Unterklassen und Unterklassen und schließlich die Enzymnummer darstellt. Die genannten Enzymklassen sind:
• 1 - Oxidoreduktasen: katalysieren Oxidations- und Reduktionsreaktionen
• 2 - Transferasen: Transfer funktioneller Gruppen (z. B. Phosphat)
• 3 - Hydrolasen: entsprechen der Hydrolyse (Zersetzung) von Bindungen
• 4-Lyasen: Brechen Sie die Bindungen durch einen anderen Mechanismus als die Hydrolyse
• 5 - Isomerasen: Sie sind für die räumlichen Veränderungen von Molekülen verantwortlich
• 6 - Ligasen: Verbinden Sie Moleküle mit kovalenten Bindungen
Enzyme und Medizin
Die Bedeutung von Enzymen für die menschliche Gesundheit ist enorm. Ihr ordnungsgemäßer Betrieb ermöglicht ein gesundes Leben, und dank der Entwicklung von Analysegeräten haben wir gelernt, verschiedene Krankheiten mittels Enzymbestimmung zu diagnostizieren. Darüber hinaus sind wir in der Lage, Mängel einiger Enzyme und die daraus resultierenden Krankheiten erfolgreich zu behandeln, aber leider gibt es in dieser Angelegenheit noch viel zu tun.
Die Behandlung der Ursachen von Stoffwechselerkrankungen ist noch nicht möglich, da wir das genetische Material nicht sicher und effektiv modifizieren können, um beschädigte Gene und damit falsch produzierte Enzyme zu reparieren.
Krankheiten, die aus dysfunktionellen Enzymen resultieren
Die ordnungsgemäße Funktion unseres Körpers hängt weitgehend von der ordnungsgemäßen Funktion der Enzyme ab. In vielen Fällen beeinflussen Krankheitszustände die Menge der Enzyme, wodurch sie übermäßig aus den Zellen freigesetzt werden oder im Gegenteil mangelhaft sind.Das Folgende sind nur Beispiele für Krankheiten, die durch abnormale enzymatische Funktionen verursacht werden. Es gibt viel mehr davon.
- Stoffwechselblockaden oder Stoffwechselerkrankungen
Stoffwechselblockaden oder Stoffwechselerkrankungen sind eine Gruppe von Erbkrankheiten, die durch die Anreicherung von Substanzen in der Zelle aufgrund des Fehlens eines für ihren Stoffwechsel verantwortlichen Enzyms verursacht werden. Im Laufe der Zeit sammeln sich so viele Substrate an, dass sie für Zellen und den gesamten Organismus toxisch werden.
Es gibt mehrere tausend dieser Krankheiten, deren Anzahl die Vielzahl der im menschlichen Körper vorkommenden Enzyme widerspiegelt, da Stoffwechselerkrankungen die meisten Gene betreffen können, die Enzyme codieren.
Beispiele sind Galaktosämie oder Homocystinurie, seltene Krankheiten, die sich meist unmittelbar nach der Geburt oder in den ersten Lebensjahren manifestieren.
- Tumoren
Eine andere Gruppe von Krankheiten, an denen eine Enzymstörung beteiligt sein kann, ist Krebs. Neben vielen anderen Funktionen sind Enzyme auch für die Regulierung der Zellteilung verantwortlich, sogenannte Tyrosinkinasen. Wenn diese Enzyme in diesem Bereich versagen, kann eine unkontrollierte Zellteilung und damit ein neoplastischer Prozess auftreten.
- Emphysem
Eine weniger häufige Erkrankung ist das Emphysem. In diesem Fall wird die Elastase überaktiv. Es ist ein im Lungengewebe vorhandenes Enzym, das unter anderem für den Abbau des in der Lunge vorhandenen Elastinproteins verantwortlich ist.
Wenn es zu aktiv ist, wird das Gleichgewicht zwischen Zerstörung und Bauen gestört, es treten Narben auf und es entsteht ein Emphysem.
Enzyme: diagnostische Verwendung
Die moderne medizinische Diagnostik basiert auf der Verwendung von Enzymen bei ihren Bestimmungen. Dies ist auf die Tatsache zurückzuführen, dass Krankheitszustände direkt oder indirekt zu einem Ungleichgewicht der Enzyme führen, was zu einer Zunahme oder Abnahme ihrer Menge im Blut führt.
Dies kann nicht nur auf Produktionsstörungen zurückzuführen sein, sondern auch beispielsweise auf die Freisetzung einer großen Menge an intrazellulärem Enzym in das Blut oder den Urin infolge einer Schädigung seiner Zellmembran.
Beispiele für in Labortests verwendete Enzyme sind:
- Kreatinkinase - ein Enzym, das in den Muskeln und auch im Herzmuskel vorhanden ist. Sein mehrfacher Anstieg kann auf einen Herzinfarkt, Myokarditis, Muskelerkrankungen - Verletzungen, Dystrophie hinweisen.
- Laktatdehydrogenase - in allen Körperzellen vorhanden, insbesondere in Gehirn, Lunge, weißen Blutkörperchen und Muskeln. Sein starker Anstieg wird bei Myokardinfarkt, Muskel- und Lebererkrankungen oder Krebs beobachtet.
- Alkalische Phosphatase kommt hauptsächlich in Leber und Knochen vor, hier wird sie von Osteoblasten freigesetzt. Krankheiten dieser Organe können ihr Wachstum verursachen, aber der Überschuss an alkalischer Phosphatase kann auch auf den Regenerationsprozess der Knochen hinweisen - nach einer Operation oder einem Bruch.
- Saure Phosphatase kommt in vielen Organen vor - Leber, Nieren, Knochen, Prostata. Aus diagnostischer Sicht kann ihr Anstieg auf Knochen- und Prostatakrankheiten hinweisen.
- Aspartat-Aminotransferase und Alanin-Aminotransferase - dies sind Enzyme, die für die Leber charakteristisch sind und fast ausschließlich in Hepatozyten vorkommen. Sie werden für die grundlegende Screening-Diagnose von Lebererkrankungen verwendet, und ihre mehrfache Erhöhung ihrer Werte führt immer zur weiteren Diagnose von Lebererkrankungen.
- Glutamatdehydrogenase und Gammaglutamyltransferase - andere Leberenzyme, ähnlich den zuvor genannten, sind wichtig für die Diagnose von Erkrankungen dieses Organs und der Gallenwege.
- Amylase ist ein Enzym, das in vielen Organen vorhanden ist. Die höchste Konzentration wird jedoch in den Zellen der Bauchspeicheldrüse und der Speicheldrüsen erreicht. Die Diagnose ist bei ihren Erkrankungen von größter Bedeutung.
- Lipase ist ein weiteres Pankreasenzym, es unterscheidet sich in seiner Spezifität von Amylase, was bedeutet, dass Lipase nur in der Bauchspeicheldrüse auftritt und Abweichungen von der Norm bei der Bestimmung dieses Enzyms auf eine Pankreaserkrankung hinweisen.
- Cholinesterase ist ein Enzym, das Acetylcholin abbaut - ein Transmitter im Nervensystem, wo es auch in der größten Menge vorhanden ist. In der Diagnostik wird es bei Vergiftungen mit Organophosphorverbindungen eingesetzt.
- Gerinnungs- und Fibrinolysefaktoren - dies sind Substanzen, die von der Leber produziert werden und an der Blutgerinnung beteiligt sind. Ihre Bestimmungen sind nicht nur für die Beurteilung dieses Prozesses wichtig, sondern auch für die Überwachung der Leberfunktion.
- Alpha-Fetoprotein - ein Leberenzym, dessen Menge bei Erkrankungen dieses Organs, einschließlich Krebs, zunimmt.
- C-reaktives Protein - wird von der Leber produziert, ist an der Immunantwort beteiligt, seine Menge steigt bei entzündlichen Erkrankungen im Blut an - Infektionen, Verletzungen, Autoimmunerkrankungen.
- Ceruloplasmin - ein weiteres Leberenzym, dessen Zunahme für Morbus Wilson charakteristisch ist.
- Pyridinolin und Desoxypyridinolin sind Marker für die Knochenresorption (Zerstörung) und charakterisieren die Funktion von Osteoklasten (osteogenen Zellen).
- Myoglobin - wie bereits erwähnt, ist dies eine für Muskeln charakteristische Verbindung, daher weist seine Zunahme auf eine Schädigung der Skelett- oder Herzmuskulatur hin.
- Troponine - die sogenannten Herzinfarktmarker - sind Enzyme, die die Kontraktion der Muskelfasern regulieren. Sie kommen besonders häufig im Herzmuskel vor. Seine Schädigung führt zur Freisetzung großer Mengen von Troponinen in das Blut, das zur Diagnose von Herzerkrankungen verwendet wird. Es sei jedoch daran erinnert, dass ein Anstieg der Troponine nicht nur auf einen Herzinfarkt hinweisen kann, sondern auch auf dessen Unzulänglichkeit, Klappendefekte oder Lungenembolie.
Alle oben aufgeführten Enzyme können in mehrere Gruppen eingeteilt werden:
- Sekretorische Enzyme - die Untergrenze der Norm ist diagnostisch. Dies sind Enzyme, die physiologisch von Organen produziert werden, aber im Fall von Krankheiten nimmt ihre Anzahl ab, z. B. Gerinnungsfaktoren
- Indikatorenzyme - Wachstum ist wichtig. Diese Gruppe von Enzymen tritt in großen Mengen aufgrund von Organschäden und Enzymleckagen auf, sie umfassen beispielsweise Troponine
- Ausscheidungsenzyme - dies sind Enzyme, die normalerweise im Lumen verschiedener Organe produziert werden - Mund, Darm oder Harnwege. Wenn ihr Auslass blockiert ist, gelangen sie ins Blut, z. B. Amylase
Es sei daran erinnert, dass Enzyme in der medizinischen Diagnose selbst verwendet werden. Biochemische Analysen werden unter Verwendung von Enzymen durchgeführt, und eine angemessene Interpretation der Ergebnisse enzymatischer Reaktionen ermöglicht es, das Ergebnis eines Labortests zu liefern.
Enzyme und Behandlung
Viele Medikamente wirken, indem sie die Wirkung von Enzymen beeinflussen, entweder indem sie sie wirken lassen oder im Gegenteil, indem sie Inhibitoren sind. Es gibt Enzymersatzstoffe wie Pankreatin, die Lipase und Amylase für Pankreasinsuffizienz enthalten.
Andererseits hemmen einige Gruppen von Arzneimitteln die Wirkung von Enzymen, z. B. Angiotensin-Converting-Enzym-Inhibitoren, die unter anderem bei Bluthochdruck und Herzinsuffizienz verwendet werden, oder einige Antibiotika, z. B. Amoxicillin, das das Enzym bakterielle Transpeptidase hemmt, das den Aufbau der bakteriellen Zellwand verhindert, und somit hemmt Infektion.
Einige Gifte wirken auch durch die Beeinflussung von Enzymen. Cyanid ist ein starker Inhibitor der Cytochromoxidase, einem wesentlichen Bestandteil der Atmungskette. Das Blockieren verhindert, dass die Zelle Energie erhält, was zu ihrem Tod führt.
Für den richtigen Verlauf der Lebensprozesse von Zellen ist es notwendig, dass viele chemische Substanzen vorhanden sind, die in strengen Anteilen untereinander verbleiben und zwischen denen ständig chemische Reaktionen stattfinden.
Diese Aufgabe wird von ordnungsgemäß funktionierenden Enzymen ausgeführt, die für nahezu jede chemische Reaktion mit der Geschwindigkeit und Effizienz erforderlich sind, die für das ordnungsgemäße Funktionieren des menschlichen Körpers erforderlich sind.
Die Wirkung von Enzymen beschleunigt diese Prozesse um ein Vielfaches, oft sogar um ein Vielfaches, was wichtig ist, da sich die Enzyme selbst während der ablaufenden Reaktionen nicht abnutzen.
Das Fehlen von Katalysatoren oder deren unangemessenes Funktionieren kann zur Entstehung vieler Krankheiten führen. Auf der anderen Seite können Sie durch geschickte Änderung ihrer Aktivität viele Krankheiten erfolgreich behandeln.
Die Enzymologie (die Wissenschaft der Enzyme) ist äußerst umfangreich und ihre Entwicklung kann nicht nur wissenschaftlichen Fortschritt bringen, sondern auch aktiv zur Entwicklung der Medizin auf dem Gebiet der Behandlung, aber auch der Diagnostik beitragen.
Über den Autor








-jest-zdrowy-ile-kalorii-ma-erytrytol.jpg)






-objawy-co-robi-w-przypadku-hipotermii.jpg)